《药学研究》·2024 Vol.43,No.3
口溶膜类新药的开发与评价探讨
新药的开发中,口溶膜类药物在特定疾病及人群方面具有一定优势,可解决传统口服制剂(如片剂、丸剂、胶囊剂等)对于口服困难的患者以及需要服药但会产生抵抗情绪的患者(如精神疾病患者)的诸多不便,因此愈发受到关注。本文对口溶膜类新药产品上市情况及开发立项建议、处方工艺开发、质量控制等方面进行探讨,希望对此类产品的开发和评价提供借鉴。
需要注意的是,并不是所有药物都适合开发成为口溶膜,企业进行口溶膜类新药的开发立项时,应对拟开发品种进行全面评估,充分考虑剂型适用性及临床优势是否充分,确认是否符合创新药或改良型新药注册分类的相关要求,降低注册风险。
《中国药典》2020年版(四部)通则中[3],膜剂系指原料药物与适宜的成膜材料经加工制成的膜状制剂,供口服或黏膜用。2023年3月14日国家药典委员会发布关于征求《中国药典》丸剂和膜剂通则修订草案公开征求意见[4],进一步将膜剂进行分类。膜剂根据给药部位不同,可分为口用膜、眼用膜、阴道膜等;其中口用膜可分为口溶膜、口颊膜、舌下膜和口腔贴膜。此外,草案增补口溶膜、口颊膜、舌下膜和口腔贴膜的定义。其中口溶膜系指在口腔可迅速溶化的膜剂;口颊膜系指黏贴于口腔,经黏膜吸收后起全身作用的膜剂;舌下膜系指置于舌下能迅速溶化,药物经舌下黏膜吸收发挥全身作用的膜剂;口腔贴膜系指黏贴于口腔,发挥局部作用的膜剂
口溶膜具有的优点包括[5]:
*可制备成不同的尺寸和形状,剂量准确;
*几分钟内即可在口腔内快速释放和分解;
*无须用水送服,无须吞咽;体积小、质量轻,便于携带;
*可通过掩味剂的加入改善药物本身的不良味道;
*服用后在口腔中几乎无残留物;部分疏水性药物可迅速分散和溶解,可能提高生物利用度等。
口溶膜适用于需要快速起效的情况,如突然发作的过敏或哮喘;适用于需要改善患者依从性的情况,如具有呕吐症状的吞咽困难患者以及需服药但会产生抵抗情绪的患者服用;口溶膜适用于儿童,其计量精准灵活、入口立即溶解,可防止儿童吐药,且可设计为不同的颜色和口味,对儿童吸引力更大。然而,口溶膜也存在其缺点和局限性,包括:在口腔pH值环境中不稳定的药物不适用;不适宜大剂量药物;易碎且必须防止进水,需要特殊包装;对黏膜有刺激作用的药物不适用等。
2006年,日本 上市了第一个口溶膜处方药伏格列波糖口溶膜。2010年,美国和欧洲 分别上市第一个口溶膜处方药昂丹司琼口溶膜(Rapidfilm和Setofilm)。2020年,国家药品监督管理局 批准了第一个口溶膜化学药品奥氮平口溶膜上市。目前,全球已有多个口溶膜产品上市,查询美国[6]、欧洲[7]、日本[8]药品监管机构网站,部分品种信息见表1。
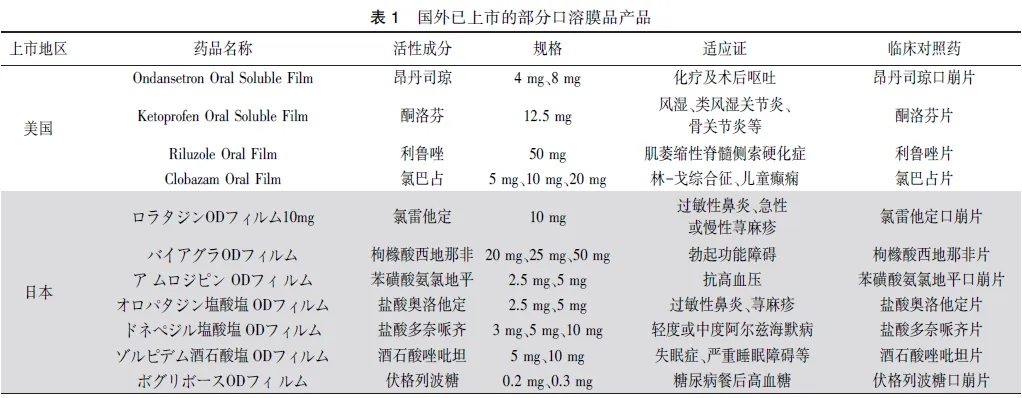
结合目前口溶膜类药品的审评情况以及对上述已上市品种的特点分析,以下情形比较适宜开发口溶膜剂型。
①在精神分裂症等特定适应证中口溶膜可充分发挥其剂型特点。例如,藏药是精神病患者依从性差的最常见表现。口溶膜具有口腔速溶性质,融化后易于吞咽,相比于已上市的口服剂型(如普通片、口崩片)具有更好的防藏药特性,利于精神病患者藏药行为的控制,对于提高患者依从性有益;
②部分品种现有剂型有限或剂型存在缺陷,口溶膜可发挥相应特定剂型特点。例如,部分治疗哮喘、呕吐类产品仅有片剂、咀嚼片、颗粒剂上市,口溶膜更利于吞咽,具有更优的患者依从性。对于其他情形,基于目前的审评认知和实践,建议企业慎重开发。关于品种立题合理性,建议开发前期与药品审评中心临床审评团队沟通。
《关于发布化学药品注册分类改革工作方案的公告》中指出,2类新药需具有明显临床优势[1]。企业拟按照2.2类进行口溶膜产品开发立项时,应对品种进行全面评估,充分考虑剂型适用性及临床优势是否充分,确认是否符合2.2类注册分类相关要求。建议企业紧紧围绕临床需求及临床优势进行开发立项,开发前期与药品审评中心做好沟通交流工作,降低注册风险。
此外企业还应详细调研拟开发产品国内外上市情况及同品种的国内外注册进展,应符合注册管理法规的相关要求并选择合理的申报路径。避免注册分类不符合要求无法受理或审批的情况发生。比如,某口溶膜产品已在韩国、印度等国家上市,如在国内按照2.2类进行申报,则与现行注册分类中相关要求不符,无法按2.2类改良型新药进行审评审批。
典型的口溶膜处方通常包括:药物活性成分(5%~30%W/W)、成膜材料(40%~50%W/W)、增塑剂(0~20%W/W),必要时添加表面活性剂(适量)、甜味剂(3%~6%W/W)、唾液刺激剂、填充剂、香精和色素等[10]。
国内批准上市的产品处方中,一般主要包括成膜材料(如羟丙甲纤维素)、增塑剂(如甘油、聚乙二醇400)、矫味剂(如三氯蔗糖、香精)、着色剂等。
调研美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市的口溶膜处方如表3所示。其中羟丙甲纤维素、羟丙基纤维素为常用的成膜材料,甘油、甘油单油酸酯为常用的增塑剂,三氯蔗糖、香精为常用的矫味剂。

通过以上已上市产品处方的梳理,可了解口溶膜产品处方的常规组成,对研发和评价具有一定参考价值。
处方研究中需重点关注成膜材料和增塑剂的选择和用量、矫味剂种类和用量对口感的影响等。
成膜材料是 药物活性成分的载体,是口溶膜处方中最重要的成分之一,一般为亲水聚合物(如羟丙甲基纤维素等)。成膜材料聚合物的种类和用量影响口溶膜的拉伸强度,聚合物的分子量影响口溶膜的溶化时限。增塑剂可提高口溶膜的机械性能,包括拉伸强度和延伸率,常见的增塑剂有甘油、聚乙二醇(PEG400)等。
增塑剂的选择 取决于其与聚合物的相容性和溶剂性质等。有研究表明,处方中增塑剂与成膜材料的比例对口溶膜的机械性能(断裂伸长率、杨氏模量、折叠耐久性)、厚度、溶出度等关键质量属性产生显著影响[15]。表面活性剂一般用于增强口溶膜的溶解度和润湿性,使药物活性成分更快释放。
甜味剂 用于掩盖药物活性成分的难闻气味和苦味。唾液刺激剂可刺激唾液腺产生唾液,帮助口溶膜快速分解。处方开发过程及临床试验期间,应关注口感指标的收集与评价(尤其活性成分味道难以掩盖的品种),并根据需要优化处方。
对于用于儿童人群的口溶膜,应特别关注辅料种类及用量在应用于儿童时的口感和安全性。儿童在不良感觉的耐受性方面有别于成人,口感不佳所导致的不良用药行为风险也相应增高,因此,相比于成人用药,儿童用药口感评价具有更强的临床意义与价值,也逐渐成为该类药品临床价值综合评价的重要内容[16]。由于儿童人群的特殊性,辅料可能会对正在发育的器官产生不同程度的影响,且成人与儿童之间、不同年龄的儿童之间可能具有不同的暴露量,导致毒性反应可能不同。因此,即使是已常规用于成人药品或在已获批儿童药品中使用的辅料,仍然需要评估现有资料是否支持在拟定儿童人群中使用。应结合辅料的已有信息,并参照相关指南进行儿童药品中辅料的安全性评估。如果支持该辅料用于拟定的儿童人群的资料不充足,则需要进一步的安全性试验[17]。
在处方开发时,还需关注 原料药粒度及晶型的研究,尤其是难溶性药物。当药物活性成分在制剂中间体药液中呈混悬状态,关注原料药粒度分布的控制,以保证配液药液及成品含量均一性,以及成品膜表面光滑平整。建议结合粒度对制剂特性(如性状外观、含量均匀性、溶出度)、生产工艺(如分散均匀性、存放稳定性)等的影响,制定粒径控制策略。除应对口溶膜的原辅料进行合理控制外,还建议关注离型膜的材质和型号的选择、质控,评估其对产品产生的影响。
膜剂的制备工艺 主要包括涂膜法、热熔挤出法、半固体溶剂浇铸法、固体分散挤压法和滚圆法等[18]。其中涂膜法是目前商业化生产口溶膜较为普遍的方法。
涂膜法 首先将成膜材料溶解于水或有机溶剂或两者的混合溶剂中,形成具有一定黏度的透明状溶液。当药物活性成分为水溶性时,应与成膜材料制成具有一定黏度的溶液;当药物活性成分为水不溶或难溶时,应将其粉碎并与成膜材料等混合均匀。再将药物和其他辅料溶解或分散到上述溶液中,真空脱气,倒入涂膜机中涂膜,真空干燥除去水分,脱模后裁剪成所需规格,即得。涂膜法是制备口溶膜常用的方法,该方法制备工艺简单,加工成本低,易于使用[19]。
工艺开发时应对参照ICHQ8[20]对生产工艺和工艺参数进行全面的筛选研究,以加强对产品性能和工艺的理解,建立工艺参数与制剂关键质量属性(如薄膜厚度、溶化时限、溶出度、水分、吸湿性、含量和含量均匀度、机械性能等)之间的关系,并采取有效的过程控制措施。在采用涂膜法生产口溶膜时,影响药品关键质量属性的高风险工艺步骤通常为配液、脱泡、涂布和干燥。配液工序建议关注对配料温度、加料顺序、混合参数的研究和控制。脱泡工序,建议考虑胶液中的气泡残留对涂布工艺和产品质量的影响。涂布和干燥工序,建议关注风量、干燥温度等参数的研究和控制,尤其当药物活性成分在胶液中呈混悬状态时,建议重点关注在工艺过程中产品的均一性,包括胶液放置过程中的均一性、涂布过程中胶液的均一性等。此外关注生产过程中是否会出现离型膜换卷或涂布过程中设备停机等情形,若存在,则建议进行风险评估,并提出相应的处理方式及其合理性依据。
涂膜法制备口溶膜生产过程中的制剂中间产品通常包括胶液、涂布干燥后药膜、裁切后药膜、内包后药膜等。应根据不同工艺的风险点,针对性地开展过程控制、中间体控制。其中胶液中间体关注样品的性状、气泡、黏度、含量、微生物限度等;涂布干燥后药膜关注样品的性状、片重、含量及含量均匀性、水分、机械性能等;裁切后和内包后药膜关注样品的尺寸、片重差异、密封性、机械性能等。
在工艺开发过程中,企业应认真分析生产规模放大对产品质量可能产生的影响,结合拟定的商业生产规模,合理选择临床试验用样品批量。建议商业化样品处方工艺、批量与关键临床试验样品保持一致,不低于10万片。
《中国药典》2020年版(四部)0125膜剂通则中规定[3],膜剂外观应完整光洁、厚度一致、色泽均匀、无明显气泡。多剂量的膜剂,分格压痕应均匀清晰,并能按压痕撕开。除另有规定外,膜剂应进行重量差异(凡进行含量均匀度检查的膜剂,一般不再进行重量差异检查)、微生物限度(微生物计数法和控制菌检查法及非无菌药品微生物限度标准检查,应符合规定)的检查。国家药典委员会发布关于征求《中国药典》丸剂和膜剂通则修订草案公开征求意见[4]中对膜剂在生产与贮藏期间的要求进行修订,增加了口感、口腔黏膜刺激性、水分、机械性能、微生物限度、溶出度、含量均匀度及残留溶剂方面的要求。在口溶膜定义中还指出,口溶膜应进行溶化时限检查,对于难溶性原料药物制成的口溶膜,还应进行溶出度检查。除常规质量控制项目外,根据膜剂的特点及关键质量属性,建议重点关注评价口溶膜的水分、口感、溶化时限、溶出度以及机械性能。
水分:口溶膜中应含有适量的水分,以保障口溶膜具有适宜的机械性能,以免包装、运输过程中发生磨损或破碎。
口感:口溶膜应口感良好,为了满足依从性需要,建议在临床研究过程中关注给药方式(口腔放置位置、溶化时限等)、黏膜黏附性和刺激性、口腔局部不良反应、口感评价等[4]。
溶化时限:现行《中国药典》膜剂通则项下并未规定溶化时限检查相关要求,但溶化时限是口溶膜产品药学质量研究及控制中需关注的重要质量指标之一。审评工作中发现,部分药品生产企业参考口崩片的检查方法和限度拟定口溶膜产品的相关方法和限度。如采用900mL水作为介质,与口溶膜药物在口腔内的实际使用环境有较大差异。因此建议模拟口溶膜使用方法及口腔环境,建立可行的溶化时限检查方法(少量溶剂),结合临床试验中在受试者口腔中的溶化时限及相关性考察,为方法及限度提供合理性依据。
溶出度:口溶膜需要快速释放药物,以确保活性药物成分在服用后可被吸收。在口溶膜开发的初期风险评估中,溶出度通常是高风险质量属性,应重点关注。在开展口溶膜溶出度方法开发时,建议考虑口溶膜膜片质轻易漂浮等制剂特点,关注溶出装置、溶出试验参数、取样时间点等选择的合理性,建立合适的、具有一定区分能力的溶出度方法。证明溶出方法区分能力时,可制备关键物料属性、关键处方组成、关键工艺参数发生变化(例如,参数在设定值±10%±20%的变化)的样品,提供不同样品溶出曲线对比数据[21]。对于难溶性药物制备的口溶膜,溶出方法建议对不同粒径的处方具有一定的区分能力[22]。
机械性能:口溶膜产品机械性能的研究不容忽视,机械性能在口溶膜药物的操作性、给药便利性和稳定性方面均有重要影响[11]。建议根据口溶膜的临床使用场景和特点,关注产品商业包装和运输装载方式,进行模拟装载、运输、随身携带(可能涉及跌落、撞击、皱褶等情况)研究,注意对可能产生的膜片碎裂等情况进行考察。
口溶膜的机械性能的评价指标可参考但不限于[10]:①抗拉强度(tensile strength):是薄膜样品在某一点断裂时施加的最大应力,计算方式为用断裂时施加的力除以薄膜的横截面积;②伸长率(percent elongation):当施加拉力时,薄膜样品会拉伸产生形变。伸长率为薄膜伸长量占原来长度的百分率。薄膜伸长率一般随增塑剂含量的增加而增加;③抗撕裂性(tear resistance):撕裂薄膜所需的最大力,记录为抗撕裂值(单位为牛顿或磅);④杨氏模量(young′s modulus):杨氏模量或弹性模量是衡量薄膜刚度的参数。表示为弹性变形区域的应力与应变之比;⑤耐折度(folding endur⁃ance):耐折度是通过将薄膜在同一位置反复折叠直至薄膜破裂来确定的,薄膜折叠不断裂的次数计为耐折度值。耐折度可用于模拟临床实际使用、运输、贮藏过程对薄膜性能的影响。建议结合口溶膜生产工艺过程控制、稳定性过程中的机械性能研究结果,合理拟定可接受标准,并考虑是否订入质量标准。
化学药品注册分类中2类为境内外均未上市的改良型新药,具体是指在已知活性成分的基础上,对其结构、剂型、处方工艺、给药途径、适应证等进行优化,且具有明显临床优势的药品。
口溶膜具有剂量准确、携带方便、患者依从性良好等特点,在部分疾病及适应证人群治疗中,口溶膜能很好解决其他剂型所带来的不便,提高患者用药依从性。需要注意的是,并不是所有药物都适合开发成为口溶膜。
企业在立项开发时 应全面评估适应证和剂型特点,充分调研产品国内外上市情况,充分考虑剂型适用性及临床优势是否充分,合理选择申报策略和路径。本文还重点探讨了口溶膜产品开发过程中的关注点和相关评价考虑。
在口溶膜处方工艺开发时,应根据产品特点,关注影响药品剂量准确性、药物快速释放、良好的口感、满足使用需求的机械强度等相关因素的评估和研究。
在口溶膜质量控制中,根据剂型特点注意水分、口感、溶化时限、溶出度、机械性能的研究,尤其应关注溶化时限方法合理性以及溶出度方法具有一定的区分能力。
原文始发于微信公众号(雾化科技展):口溶膜类新药的开发与评价关注点
电子雾化与HNB产品都是新型电子产品,结构虽小,却融合应用多种材料、表面处理、芯片电子等技术工艺,而且雾化技术一直在不断更迭,供应链在逐步完善,为了促进供应链企业间有一个良好的对接交流,艾邦搭建产业微信群交流平台,欢迎加入;Vape e-cigarettes (VAPE) and Heat-Not-Burn e-cigarettes (HNB) are both emerging electronic products. Despite their compact size, they integrate various materials, surface treatment technologies, chip electronics, and other advanced technical processes. Moreover, atomization technology is constantly evolving and the supply chain is being progressively perfected. To facilitate good communication and networking among supply chain enterprises, Aibang has established an industry WeChat group communication platform and warmly welcomes interested enterprises to join.

